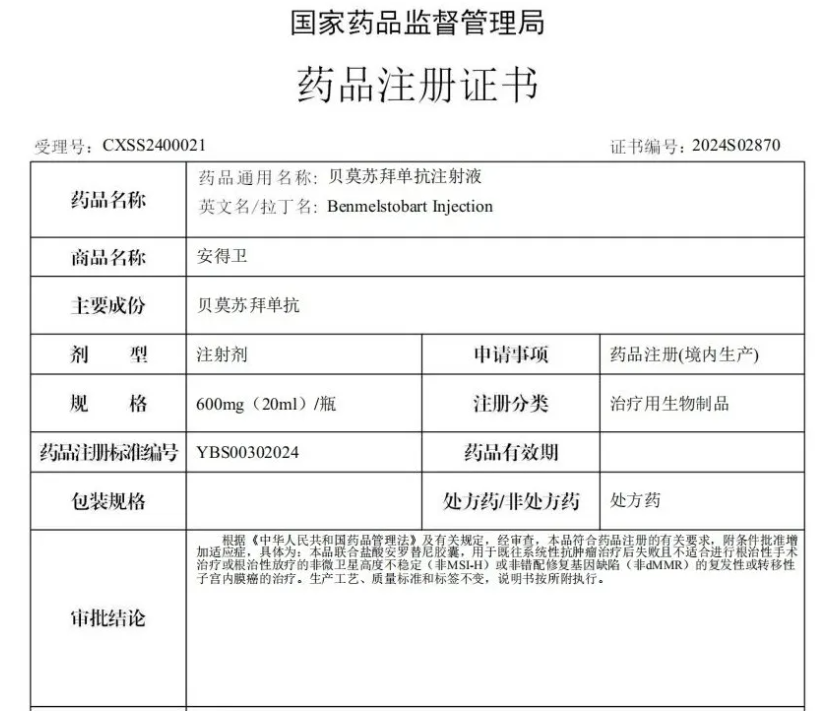
11 月 27 日,正大天晴宣布,贝莫苏拜单抗在国内获批新适应症,联合盐酸安罗替尼胶囊用于治疗既往接受过一、二线化疗方案治疗失败或不能耐受的非微卫星高度不稳定(非 MSI-H)或非 DNA 错配修复缺陷(非 dMMR)的复发性或转移性子宫内膜癌(CXSS2400021)。
贝莫苏拜单抗(TQB2450) 是正大天晴自主研发的一款全新序列的创新人源化 PD-L1 单克隆抗体。2024 年 5 月在国内获批,适应症为联合安罗替尼、卡铂和依托泊苷用于广泛期小细胞肺癌(ES-SCLC)患者的一线治疗。2022 年 4 月,贝莫苏拜单抗子宫内膜癌适应症曾被 CDE 纳入突破性治疗。
2024 国际妇科肿瘤学会 (IGCS) 年会上,正大天晴公布了贝莫苏拜单抗联合安罗替尼治疗复发性或转移性子宫内膜癌的Ⅱ期研究(ETER200)。研究数据显示,85 例非 MSI-H/非 dMMR 患者的客观缓解率(ORR)为 34.1%,疾病控制率(DCR)为 77.7%,中位无进展生存期(PFS)为 8.8 个月,中位总生存期(OS)为 21.8 个月,展现了贝莫苏拜单抗联合安罗替尼对于子宫内膜癌的治疗潜力。
2024 ASCO 大会上公布了贝莫苏拜单抗联合安罗替尼二/三线治疗复发或转移性子宫内膜癌的 II 期临床研究 TQB2450-II-08 研究最新积极数据。
截至数据截止日期(2023 年 11 月 9 日),共纳入 170 例既往接受过 1-2 线含铂化疗治疗失败的复发性或转移性晚期子宫内膜癌患者。共分为 3 个队列:
队列 1(n=107),非 MSI-H/dMMR 患者接受贝莫苏拜单抗(1200mg,IV D1/Q3W),安罗替尼(12mg PO QD,D1-14/Q3W);
队列 2(n=32),MSI-H/dMMR 患者接受贝莫苏拜单抗治疗;
队列 3(n=31),非 MSI-H/dMMR 患者接受安罗替尼治疗,直至疾病进展或毒性无法耐受。
队列 1-3 中,IRC 评估的 ORR 分别为 31.76%、34.38% 和 22.58%;中位 PFS 分别为 8.38 个月、8.21 个月和 6.80 个月;中位 OS 分别为 21.72 个月、27.66 个月和 16.03 个月。
安全性方面,队列 1-3 任意级别的 TEAEs 发生率分别为 99.07%、100% 和 100%;≥3 级 TEAEs 发生率分别为 74.77%、40.63% 和 87.10%;最常见的 TEAEs 为高血压、甲状腺功能减退症、体重降低和白细胞计数降低等。
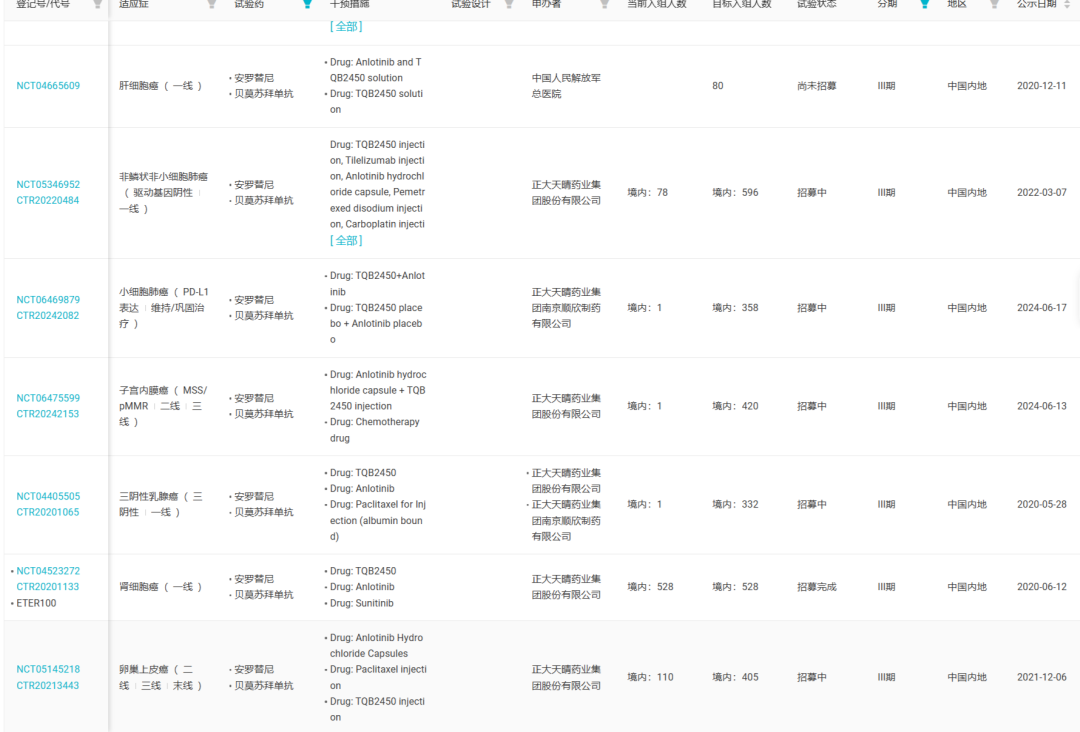
除了已获批的两个适应症外,据 Insight 数据库显示,贝莫苏拜单抗联合安罗替尼还被开发用于非小细胞肺癌放化疗后维持/巩固治疗、晚期鳞状非小细胞肺癌的一线治疗、晚期子宫内膜癌的一线治疗、晚期胆道癌的二线治疗、三阴性乳腺癌的一线治疗和晚期食管鳞癌的一线治疗等。
其中,贝莫苏拜单抗联合安罗替尼一线治疗晚期不可切除或转移性肾细胞癌(RCC)的适应症在今年 8 月递交上市申请,目前正在审评中(CXSS2400082),Insight 数据库预计 2025 年 Q2 获批。
目前,国内晚期、转移性或复发性子宫内膜癌的一线系统治疗方案主要是紫杉醇联合卡铂的化疗,但对于铂类化疗失败后的晚期子宫内膜癌,尚无明确的标准治疗方案,亟需有效治疗方式。
随着免疫治疗的进展,复发性或转移性子宫内膜癌后线治疗也迎来了新进展。2021 年 7 月,FDA 完全批准 PD-1 单抗帕博利珠单抗联合仑伐替尼用于既往接受系统性治疗后疾病进展、非 MSI-H/dMMR 的复发性或转移性子宫内膜癌。遗憾的是,该方案目前未在国内获批。
此次贝莫苏拜单抗新适应症的获批,将为复发性或转移性子宫内膜癌后线治疗提供新选择。
文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担, 关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部责任。本公众号发布的各类文章重在分享,如有侵权请联系我们,我们将会删除。
(转自:求实药社)










发表评论