炒股就看金麒麟分析师研报,权威,专业,及时,全面,助您挖掘潜力主题机会!
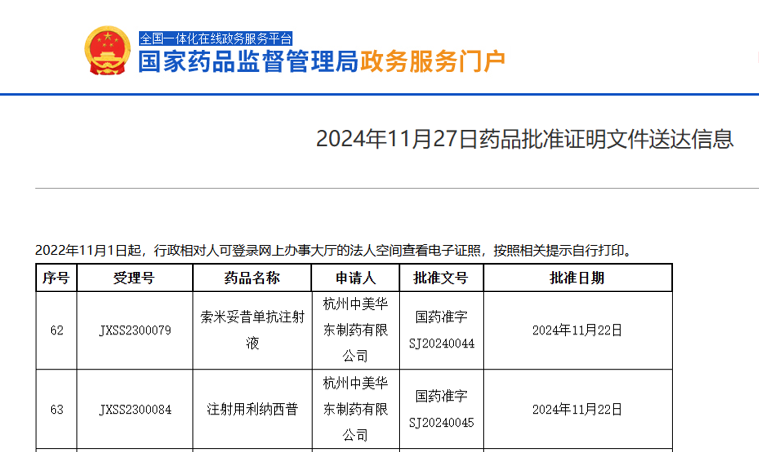
11月27日,国家药监局网站显示,华东医药的两款创新药获批上市,一款为索米妥昔单抗(IMGN853/HDM2002),另一款为利纳西普。
▌索米妥昔单抗
索米妥昔单抗获批用于治疗既往接受过1-3线系统治疗、FRα阳性、铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成年患者。
索米妥昔单抗是ImmunoGen开发的一款first in class叶酸受体α(FRα)ADC,由FRα结合抗体、可裂解的连接子和美登木素生物碱DM4组成。2020年10月,华东医药与ImmunoGen达成协议,以4000万美元首付款和最高2.65亿美元里程碑付款以及约定比例的销售额提成费获得索米妥昔单抗在中国的开发和商业化权益,而ImmunoGen则保留该产品中国以外地区的所有权益。
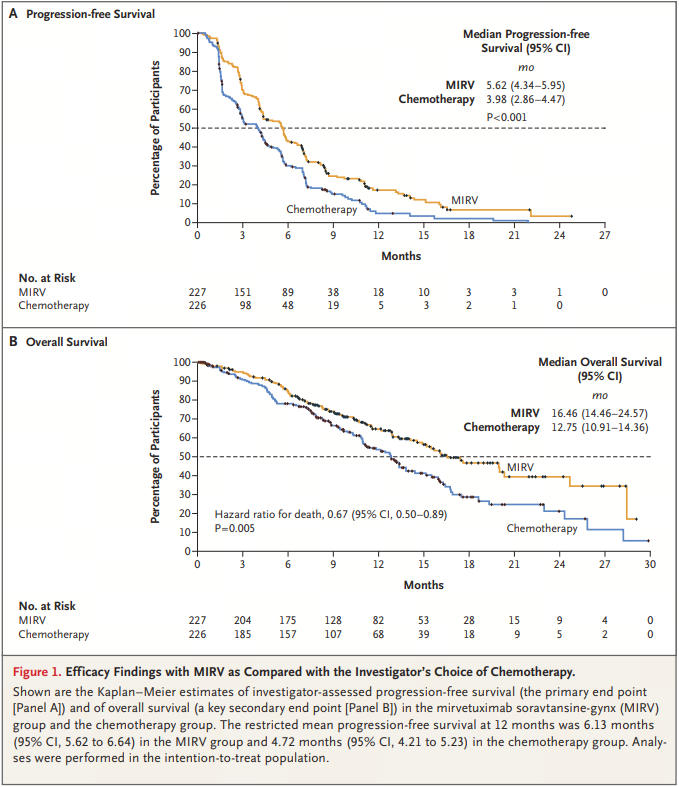
2022年11月,索米妥昔单抗凭借单臂III期SORAYA研究的积极结果获FDA加速批准上市,商品名为Elahere。随着验证性III期研究的顺利完成,索米妥昔单抗也在今年3月获得了FDA的完全批准。结果显示,相比化疗组,索米妥昔单抗组FRα阳性铂耐药卵巢癌患者的总生存期(OS)显著延长(16.46 vs. 12.75个月,HR=0.67,P=0.005),无进展生存期(PFS)亦显著延长(5.62 vs. 3.98个月,P<0.001)。
根据ImmunoGen财报,索米妥昔单抗放量迅速,其2023年前三季度销售额已达到2.12亿美元。
▌利纳西普
利纳西普(Rilonacept)获批用于治疗成人和12岁及以上青少年冷吡啉相关周期性综合征(CAPS),包括家族性寒冷型自身炎症综合征(FCAS)、Muckle-Wells综合征(MWS)。
Rilonacept是再生元开发的一款白细胞介素-1受体(IL-1R)-Fc融合蛋白,可阻断IL-1α和IL-1β介导的信号传导,进而抑制炎症反应。2008年2月,Rilonacept获FDA批准上市,商品名为Arcalyst。截至今日,Rilonacept在美国已获批3项适应症,包括CAPS、IL-1R拮抗剂缺乏症(DIRA)和心包炎(RP)。今年3月,华东医药也提交了Rilonacept治疗RP的新适应症上市申请。
Rilonacept的权益曾几经转手。2003年3月,诺华决定与再生元合作开发和商业化Rilonacept。但该合作在2009年6月宣告终止。2017年9月,Kiniksa Pharmaceuticals与再生元达成合作,获得了Rilonacept的开发和商业化权益。2022年2月,华东医药以6.62亿美元的总交易额将Rilonacept以及另一款自免产品的亚太权益(不含日本权益)收入囊中。
CAPS是一种罕见病,在Rilonacept获批之前国内尚无有效治疗药物,该药物也因此被纳入CDE发布的《临床急需境外新药名单(第一批)》。
文章内容仅供参考,不构成投资建议。投资者据此操作,风险自担, 关于对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。请读者仅作参考,并请自行承担全部责任。本公众号发布的各类文章重在分享,如有侵权请联系我们,我们将会删除。
(转自:求实药社)







发表评论